Bileşiklerin Asitlik ve Bazlık Özellikleri
Bileşiklerin asitlik ve bazlık özellikleri konusuna geçmeden önce bir bileşiğin asit mi yoksa baz mı olduğunu nasıl anlayabileceğimizi anlatacağız. Çünkü bir bileşiğin gözle asit ya da baz olduğu anlaşılmaz. Bunu 3 yöntem ile yapabiliriz.
Bir Bileşik Asit mi Baz mı?
Dediğimiz gibi bunun için 3 yöntem kullanılmaktadır. Bunlardan en tehlikesizi bir turnusol kağıdı kullanmak. Elinizdeki bileşiği bir turnusol kağıdına döktüğünüz zaman turnusol kağıdının rengi kırmızı renkte oluyorsa o bileşik asittir. Eğer turnusol kağıdı mavi renkte oluyorsa o zaman o bileşik bazdır.
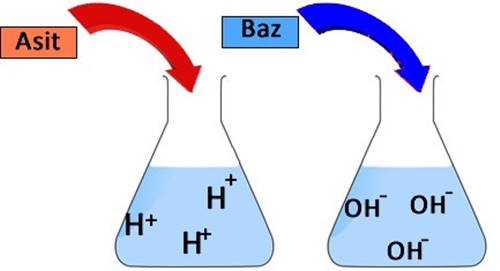
Diğer yöntem sulu bir çözeltide incelemek. Elinizdeki bileşik, sulu bir çözeltide hidrojen iyonu (H+) bulundurursa bu bileşik bir asittir. Eğer hidroksit iyonu (OH–) bulundurursa o zaman da bu bileşik bir bazdır.
Son yöntem ise tadına bakmak. Ama çok dikkatli olmalısınız çünkü tehlikeli olabilir. Eğer tadına bakacak olursanız, elinizdeki bileşiğin tadı ekşi ise asit, acı ise bazdır.
Bileşiklerin Asitlik Özellikleri
Bir bileşik eğer asit ise özellikleri şöyledir:
1 – Asitlerin tadı ekşidir.
2 – Cildinizi tahriş etmektedir.
3 – Asitli sulu çözeltiler elektriği iletirler.
4 – Eğer asitli bir bileşiği turnusol kağıdına dökerseniz turnusol kağıdı kırmızı renge döner.
Asitli bileşiklere örnek olarak:
- Hidroklorik asit (HCl –> H+ + Cl–)
- Sülfürik asit (H2SO4 –> 2H+ + SO4-2)
- Hidrojen sülfüt (H2S –> H+ + SO-2)
- Hidrojen siyanür (HCN –> H+ + CN–)
verilebilir.
Bileşiklerin Bazlık Özellikleri
Bir bileşik eğer baz ise özellikleri şöyledir:
1 – Bazların tadı acıdır.
2 – Bazlı bir bileşiği elinize döktüğünüz zaman elinizde kayganlık hissi verir.
3 – Cildinizi tahriş etmektedir.
4 – Bazlı sulu çözeltiler elektriği iletirler.
5 – Eğer bazlı bir bileşiği turnusol kağıdına dökerseniz turnusol kağıdı mavi renge döner.
Baz bileşiklere örnek olarak:
- Potasyum hidroksit (KOH –> K+ + OH–)
- Kalsiyum hidroksit (CA(OH)2 –> Ca+2 + OH–)
- Sodyum hidroksit (NaOH –> Na+ + OH–)
- Alüminyum hidroksit (Al(OH)3 –> Al+3 + OH–)
- Amonyum hidroksit (NH4OH –> NH4+ + OH–)
verilebilir.