Sodyum Elementinin Özellikleri (Özet)
Atom numarası 11 olan Sodyum elementinin periyodik tabloda 1A grubu, 3. periyot, s orbitali bölümünde yer almaktadır. Element sembolü (simgesi) “Na” olan Sodyum, Alkali metaller element serisine ait, elektron dizilimi Ne 3s¹ ve gümüşümsü beyaz bir görünüme sahiptir. Doğada katı halinde bulunan ve hacim merkezli kübik bir yapıya sahip Sodyum elementinin atom ağırlığı 22,98976928(2) g/mol olup katı halindeki yoğunluğu 0,968 g/cm³ iken sıvı halindeki yoğunluğu ise 0,927 g/cm³.
Sodyum Tüm Özellikler
- Simgesi: Na
- Atom numarası: 11
- Grup: 1A
- Periyot: 3
- Orbital: s
- Elektron dizilimi: 3s¹
- Element serisi: Alkali metaller
- Atom ağırlığı: 22,98976928(2) g/mol
- Yoğunluk: 0,968 g/cm³
- Ergime noktası: 97,72 °C
- Kaynama noktası: 883 °C
- Ergime ısısı: 2,60 kJ/mol
- Buharlaşma ısısı: 97,42 kJ/mol
- Isı kapasitesi: 28,230 J
- Elektronegatiflik: 0,93 Pauling ölçeği
- İyonlaşma enerjisi: 495,8 kJ/mol
- Atom yarıçapı: 180 pm
- Kovalent yarıçapı: 154 pm
- Van der Waals yarıçapı: 227 pm
- Isıl iletkenlik: 142 W/(m*K)
- Ses hızı: 3200 m/s
- Mohs sertliği: 0.5
- Vickers sertliği: — MPa
- Brinell sertliği: 0.65 MPa

Alkali metallerin tamamı ise şöyle;
- Lityum (Li)
- Sodyum (Na)
- Potasyum (K)
- Rubidyum (Rb)
- Sezyum (Cs)
- Fransiyum (Fr)
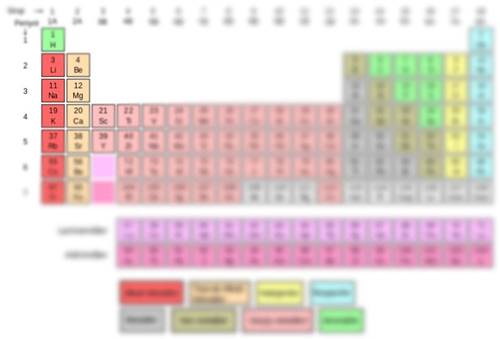
Sodyum Elementinin Periyodik Tablodaki Yeri
Sodyum Elementinin Tarihi (Özet)
Sir Humphry Davy tarafından 1800’lü yılların başında bileşikler halinde kullanılmıştır. Ortaçağda ise Avrupa’da baş ağrısı ilacı olarak da kullanılmıştır. Simgesi olan Na ise Latince olan Natrium kelimesinin ilk harfleri olan Na’dan alınmıştır. En çok bulunan 4. elementtir. Ama en çok bulunan alkali metal. Ayrıca 19. y.y. sonlarında ise sodyum karbonat ile karbon birlikte 1100 dereceye kadar ısıtılmış ve böylece kimyasal olarak sodyum elde edilmiştir.
